13.6. Ревматоидный артрит
Ревматоидный артрит (РА) -хроническое заболевание суставов, неизвестной этиологии, с которым связано значительное нарушение трудоспособности и необходимость значительных затрат в области здравоохранения. Характеренхронический воспалительный синовит ,обычно с симметричным вовлечением периферических суставов, который может прогрессировать с развитием деструкции хряща, костных эрозий и деформаций. Наиболее часто встречающиеся симптомы: боль, припухание и болезненность пораженных суставов; утренняя или постоянная скованность, общие симптомы, такие как слабость, быстрая утомляемость, похудание. Внесуставные проявления включают ревматоидные узлы, васкулит, офтальмологическую патологию. Начало РА может быть постепенным или, менее часто, острым.
В популяции РА развивается приблизительно у 0,8% (от 0,2% до 2,1%). Уровень общей заболеваемости увеличивается с возрастом, наиболее характерен дебют заболевания в возрасте сорока-пятидесяти лет. Женщины поражаются приблизительно в три раза чаще мужчин, однако эти различия уменьшаются с возрастом. Вероятно, в этиологии РА играют роль как наследственность, так и факторы внешней среды. Генетическая предрасположенность связана с главным комплексом гистосовместимости II класса и кодируется HLA-DR генами .
Функциональная недостаточность часто имеет место на ранних стадиях РА и у большинства пациентов прогрессирует. В течение 2 лет от начала РА более 70% пациентов имеют рентгенологические признаки поражения суставов. Темпы прогрессирования максимальны на ранних стадиях заболевания.
Патогенез ревматоиднго артрита.
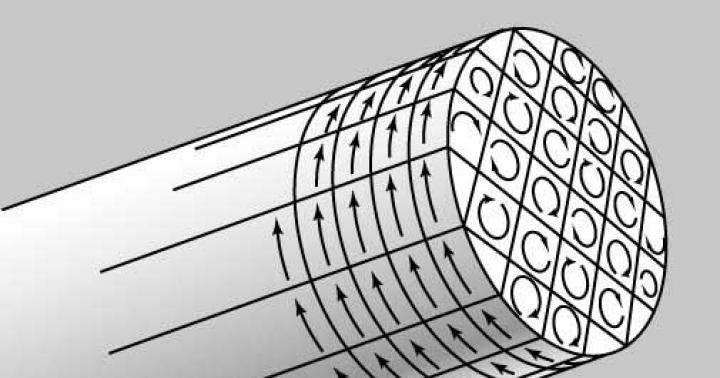
В норме сустав выстлан синовиальной мембраной, которая состоит из 2 слоев клеток, покрывающих соединительную ткань и кровеносные сосуды. Синовиальная мембрана состоит из клеток типа А, имеющих костномозговое происхождение и принадлежащих к макрофагальной линии, и клеток типа В - тканевых клеток, имеющих мезенхимальное происхождение.
У больных РА в пораженных суставах развивается массивная инфильтрация клетками крови, имеющими костномозговое происхождение - моноцитами и лимфоцитами, которые, в основном, инфильтрируют саму синовиальную мембрану, и полинуклеарными лейкоцитами, которые мигрируют в синовиальную жидкость.
Эти иммунные клетки продуцируют цитокины, которые связываются с рецепторами на поверхности иммунных и других типов клеток и регулируют каскад реакций, в результате которого развивается хроническое воспаление. Воспаленную синовиальную мембрану называют паннусом, она богато васкуляризирована. Помимо воспаления синовиальной мембраны, паннус инициирует местные деструктивные процессы, ведущие к повреждению хрящевой ткани.
Цитокины могут потенциировать или подавлять воспаление. В пораженных суставах при РА провоспалительные цитокины преобладают над противовоспалительными Ключевым провоспалительным цитокином, способствующими развитию как хронического воспаления, так и деструкции хряща и потере костной ткани, является фактор некроза опухоли (TNFα). TNFαпродуцируется, главным образом, макрофагами и Т-лимфоцитами.
TNFαпроявляет целый ряд провоспалительных эффектов :
способствует воспалительному ответу и индуцирует экспрессию других провоспалительных цитокинов, включая IL-1, IL-6, IL-8 и GM-CSF, индуцирует экспрессию молекул адгезии, таких как межклеточные молекулы адгезии (ICAM) и Е-селектин, которые способствуют дальнейшей инфильтрации синовиальной мембраны иммунными клетками;
может усиливать продукцию таких ферментов, как металло-протеиназы,которые усугубляют разрушение хрящевой и других тканей.
Действие TNFαи других цитокинов, вероятно, лежит в основе многих проявлений ревматоидного синовита, таких как воспаление тканей, повреждение хряща и костной ткани, и системных проявлений ревматоидиого артрита.
Диагностика РА.
Для установления диагноза используются критерии классификации РА Американской Ревматологической Ассоциации, пересмотренные в 1987 году.
Дифференциальный диагноз следует проводить с системной красной волчанкой, гонококковым артритом, болезнью Лайма, анкилозирующим спондилоартритом и остеоартритом.
Ддиагностические критерии ревматоидного артрита
При установлении диагноза могут быть полезными лабораторные данные .Ревматоидный фактор , который представляет собой аутоантитела к Fc-фрагменту IgG 1, не является специфичным для РА, но присутствует более чем у 67% больных РА. У пациентов, имеющих высокие титры ревматоидного фактора, более вероятно тяжелое течение заболевания и внесуставные проявления.Скорость оседания эритроцитов (СОЭ) повышена практически у всех пациентов с активным РА. Другие острофазовые показатели, в том числеС-реактивный белок (СРВ), также повышены, и их уровень коррелирует с активностью заболевания.
Лечение РА.
Целью лечения является уменьшение боли, улучшение или поддержание функции суставов, снижение выраженности синовита, предотвращение повреждения структур суставов, поддержание функций и контроль над системными проявлениями. Лечение включает нелекарственные методы, такие как отдых, физиотерапия и гимнастика, фармакотерапию и хирургические методы.
Фармакотерапия РА включает как препараты, уменьшающие выраженность симптомов, так и препараты, модифицирующие течение заболевания.
Классификация антиревматической терапии (по материалам 5 заседания Международной Лиги по Борьбе с Ревматизмом Всемирной Организации Здравоохранения (МЛБР/ВОЗ), 1993 год). В эту классификацию включены категории, разработанные европейскими экспертами, она подразделяет препараты:
тип А (симптом-модифицирующие),
тип В (болезнь-модицифирующие)
тип С (структурно-модифицирующие).
Классификация антиревматических препаратов
Класс симптом-модифицирующихантиревматических препаратов включает нестероидные противовоспалительные препараты (НПВП) и кортиокостероиды. Последние надежно и быстро купируют симптомы воспаления, однако вызывает опасения их способность вызвать серьезные токсические эффекты. Представляется наиболее вероятным, что частота развития побочных эффектов кортикостероидов зависит от дозы. Есть данные, позволяющие предположить, что низкие дозы кортикостероидов могут замедлить рентгенологическое прогрессирование эрозивного артрита.
Модифицирующие болезньантиревматические препараты назывались также медленно действующими антиревматическими препаратами. Этот класс включает целый ряд препаратов, в том числе МТ, циклофосфамид, антималярийные препараты, соли золота. Механизм действия многих при РА неизвестен. Предполагается, что многие из них обладают минимальным, неспецифическим противовоспалительным или анальгетическим действием.
Метотрексат (МТ), антагонист фолиевой кислоты, стал стандартом терапии больных РА. Хотя известно, что МТ ингибирует определенные ферменты, его механизм действия при РА, обеспечивающий антивоспалительное и иммуносупрессивное действие, может быть несколько шире
В связи с тяжестью клинических проявлений и прогрессирующим характером РД все большее признание получает агрессивный подход к лечению. Такой подход подразумевает раннее назначение и их комбинирование для оптимального контроля над воспалением и уменьшения деструкции суставов на протяжении заболевания. Когда монотерапия неэффективна, широко используются комбинации различных препаратов.
По мере улучшения нашего понимания иммунологических процессов, лежащих в основе РА, развиваются новые биологические методы лечения, направленные на специфические компоненты иммунной системы. В противоположность относительно неспецифическим эффектам многих, точный механизм действия которых неизвестен, биологические методы лечения направлены на специфические молекулы, принимающие участие в определенных воспалительных и иммунных процессах. Анти-TNF-а терапия - новый метод, при котором связывается и ингибируется ключевой провоспалительный цитокин - фактор некроза опухоли альфа.
Анти- TNF α терапия
Анти- TNF α терапия представляет собой чрезвычайно важный новый подход к лечению в тех случаях, когда оно неэффективно, и РА прогрессирует, несмотря на рано начатую агрессивную терапию. Современные руководства рекомендуют рассматривать возможность назначения анти-TNF α терапии пациентам с активным РА после неэффективного лечения одним или более препаратами, из группы модифицирующих болезнь. Активный РА может быть определен по нескольким показателям, включая Индекс Активности Болезни (DAS) >3,2, не менее 15 припухших или болезненных суставов, повышение сывороточной концентрации СРБ или СОЭ.
Для цитирования:
Бадокин В.В. Основные симптом–модифицирующие препараты замедленного действия в терапии остеоартроза // РМЖ. 2011. №12. С. 725
Остеоартроз (ОА) является основной нозологической формой дегенеративных заболеваний суставов. Он встречается более чем у 70% больных в возрасте 65 лет и еще чаще выявляется рентгенологическая симптоматика этого заболевания . ОА вовлекает в орбиту своего патологического процесса в первую очередь нагрузочные (коленные и тазобедренные) суставы и этим значительно ухудшает качество жизни больных, приводит к инвалидизации, прежде всего лиц пожилого возраста. Он представляет серьезную социально-экономическую проблему, являясь одной из основных причин стойкой потери трудоспособности. По данным EULAR (2003), риск нетрудоспособности вследствие остеоартроза коленных суставов равен риску, связанному с заболеваниями сердца, и находится на 4 месте среди основных причин нетрудоспособности у женщин и на 8 месте - у мужчин . Отдаленный прогноз ОА у конкретных больных трудно предсказать, включая течение отдельных клинических симптомов, прогрессирование рентгенологических (струк-турных) изменений и нарушение качества жизни.
ОА рассматривается, как мультифакториальное заболевание, в развитии которого принимают участие различные факторы (механические, гормональные, генетические). Вклад этих факторов в развитие, отдельные проявления и исход этого заболевания у конкретных больных чрезвычайно вариабелен. Хорошо известно, что при гонартрозе, коксартрозе и артрозе мелких суставов кистей принимают участие различные факторы риска. Это дало возможность некоторым авторам рассматривать ОА, как гетерогенную группу заболеваний суставов различной этиологии, но со сходными биологическими, морфологическими и клиническими признаками и общим исходом . В основе остеоартроза лежит нарушение равновесия между анаболическими и катаболическими процессами в тканях сустава, и прежде всего в гиалиновом хряще - основном и первичном плацдарме патологических изменений. Заболевание характеризуется хроническим медленно прогрессирующим течением и приводит к уменьшению объема гиалинового хряща, вплоть до полной его потери.
Патогенез первичного остеоартроза во многом расшифрован (в частности, молекулярные механизмы его развития). Решающее значение придается хронической перегрузке суставов, включая их микро- и макротравматизацию. Это приводит к нарушению активности хондробластов и хондроцитов, а затем к недостаточному синтезу протеогликанов хондроцитами, а также количественному и качественному нарушению образования гликозаминогликанов и протеогликановых агрегатов. С другой стороны, наблюдаются изменения в субхондральной кости, развивается ее склероз, что еще более увеличивает нагрузку на пораженный сустав. Важное значение имеет активация матричных протеиназ (коллагеназы, фосфолипазы А2), гиперэкспрессия провоспалительных цитокинов (интерлейкина-1 и фактора некроза опухоли-α), дефицит противовоспалительных цитокинов, например, трансформирующего фактора рос-та-β и ингибитора плазминогена-1, которые ингибируют анаболические процессы в пораженном хряще. Определен-ную роль в патогенетическом каскаде остеоартроза принадлежит супероксидным радикалам, уменьшению синтеза синовиоцитами гиалуроновой кислоты, а также гиперпродукции простагландина Е2, что наряду с другими факторами способствует воспалению в тканях сустава, стимулирует активность остеобластов и индуцирует фибропластическую дегенерацию хряща.
Патологические изменения при остеоартрозе (ОА) отражают как повреждение тканей сустава, так и реакцию на это повреждение. Хотя наиболее выраженные изменения происходят в суставном хряще, но в патологический процесс вовлекаются все ткани сустава и периартикулярные мягкие ткани. Помимо дегенерации и уменьшения объема гиалинового хряща, наблюдается воспаление синовиальной оболочки, а также костное ремоделирование с субхондральным склерозом, формированием остеофитов и субхондральных кист, фиброз суставной капсулы, дегенерация менисков, периартикулярная мышечная атрофия. Кроме этого, в патологический процесс вовлекаются связки, энтезы, чувствительные нервы .
Заинтересованность всех структур, составляющих сустав, который можно рассматривать как самостоятельный орган, приводит к различным механизмам возникновения боли - одного из ведущих симптомов этого заболевания. Так, поражение субхондральной кости способствует развитию боли путем возникновения внутрикостной гипертензии и микропереломов, сформировавшиеся остеофиты приводят к травматизации чувствительных нервов, а поражение периартикулярных мышц сопровождается их спазмом. Однако важнейшее значение в происхождении боли принадлежит воспалению, которое имеет первостепенное значение в развитии и прогрессировании ОА .
Воспалительный процесс локализуется не только в синовиальной оболочке, но и в хряще, кости и в периартикулярных мягких тканях, включая суставную капсулу, связки и сухожилия, что сопровождается соответственно развитием синовита, хондрита, остита и периартрита. Многоплановый характер поражения при ОА стал более доказательным с введением в клиническую практику новых технологий, в частности, магнитно-резонансной томографии (МРТ). МРТ помогает определить фенотип ОА, уточнить взаимоотношения между болью и структурными изменениями при этой болезни, визуализировать топику поражения и идентифицировать мишени для терапии . Этот метод позволяет выявить морфологические изменения в различных тканях сустава при наличии минимальных рентгенологических изменений или даже при их отсутствии. Пока мало известно о клинической значимости МРТ симптоматики, но все же ясно, что изменения костного мозга ассоциируются с высокой скоростью рентгенологического прогрессирования ОА, а боль коррелирует с синовитом и отеком костного мозга (вероятно, внутрикостной гипертензией).
Лечение этого заболевания является комплексным и включает нефармакологические, фармакологические и клинические методы. К методам фармакотерапии относятся неопиоидные и опиоидные анальгетики (парацетамол, трамадол), системные нестероидные противовоспалительные препараты (НПВП), локальная терапия (капсаицин, НПВП, димексид), так называемые хондропротекторы (симптом-модифицирующие препараты замедленного действия), внутрисуставные инъекции (глюкокортикоиды, препараты гиалуроновой кислоты), экспериментальная терапия (модуляторы биологического ответа, препараты, воздействующие на метаболизм костной ткани).
Из симптом-модифицирующих препаратов замедленного действия первостепенное значение имеют естественные компоненты хрящевого межклеточного вещества - глюкозамин и хондроитин сульфат, которые являются наиболее изученными среди препаратов этой группы и более доказательными . Их относят к специфическим противоартрозным средствам, которые характеризуются более медленным развитием симптом-модифицирующего действия, выраженным последействием, когда после прекращения лечения эффект сохраняется в течение 4-8 и более недель и самое главное - они обладают потенциальными структур-но-мо-дифицирующими (хондропротективными) свойствами . Следовательно, глюкозамин и хондроитина сульфат не только активно воздействуют на основные клинические проявления этого заболевания (а именно), подавляют боль и нормализуют функцию пораженных суставов, но и замедляют темпы прогрессирования ОА, нормализуют или стабилизируют структурные изменения в гиалиновом хряще, предупреждают изменения в непораженном суставе (табл. 1).
Наиболее солидную доказательную базу имеет глюкозамин . Он является моносахаридом и естественным компонентом гликозаминогликанов суставного матрикса и синовиальной жидкости. Глюкозамин обладает специфическим влиянием на остеоартритический хрящ и стимулирует синтез хондроцитами полноценного экстрацеллюлярного матрикса, и прежде всего наиболее важной его составляющей - протеогликанов и гиалуроновой кислоты (табл. 2). Он достоверно снижает активность катаболических энзимов в хряще, включая матриксные металлопротеиназы .
Глюкозамин синтезируется из хитина морского происхождения и содержит несколько солей . В лечебной практике применяются две его соли - сульфат и гидрохлорид. Глюкозамин сульфат является чистой субстанций с молекулярным весом 456.46 и представляет собой сульфатированный дериват естественного аминомоносахарида глюкозамина. Он является нормальным компонентом глюкозаминогликанов и протеогликанов, а также субстратом для синтеза цепей гликозаминогликанов, аггрекана и других компонентов хряща. При приеме внутрь или при парентеральном введении он накапливается в суставном хряще. Его характеризует быстрое всасывание из желудоч-но-ки-шечного тракта. Абсолютная биодоступность после первого прохождения через печень составляет 26%. При внутримышечном введении концентрация глюкозамина сульфата обычно в 5 раз выше, чем при его приеме per os.
В систематическом Кокрановском обзоре, в котором анализировались наиболее значимые исследования по изучению эффективности и переносимости глюкозамина, дана высокая оценка его симптоматического действия . Эффективность глюкозамина достоверно выше по сравнению с плацебо в плане уменьшения интенсивности болей в суставах, улучшения индекса Лекена, а также процента больных, ответивших на проводимую терапию. В то же время не получено достоверных результатов при сравнительной оценке эффективности глюкозамина и плацебо по таким параметрам, как уменьшение боли по шкале индекса WOMAC, скованности, а также улучшение функции пораженных коленных суставов .
Говоря о глюкозамине, нельзя обойти два солидных исследования, в которых был зарегистрирован структурно-модифицирующий эффект этого препарата . В первом из этих исследований 212 больных были рандомизированы на 2 группы, которые регулярно в течение 3 лет принимали глюкозамин сульфат или плацебо. Ширина суставной щели увеличилась к концу исследования на 0,12 мм в основной группе, принимающих глюкозамина сульфат, а в группе плацебо - уменьшилась на 0,24 мм. Эти данные свидетельствуют не только о симптом-модифицирующей, но и структурно-модифицирующей эффективности этого препарата, т.е. его способности активно воздействовать на темпы прогрессирования ОА. Однако далеко не у всех больных при многолетнем лечении глюкозамином удалось достигнуть снижения темпов рентгенологического прогрессирования. Так, после трехлетнего непрерывного приема этого препарата наблюдалось быстрое прогрессирование заболевания у 15% больных, при этом сужение суставной щели превышало 0,5 мм . Факторы риска такого агрессивного течения ОА пока не идентифицированы. Следует также отметить, что терапевтическая активность глюкозамина показана только у больных с гонартрозом, но не коксартрозом.
Позже структурно-модифицирующий эффект глюкозамина был получен Pavelka и соавт. . Косвенно эти данные подтверждаются результатами длительного (в среднем 8-летнего) наблюдения за больными, которые лечились глюкозамином в первые 3 года наблюдения. В последующие 5 лет эндопротезированию коленного сустава было подвергнуто 10,2% больных основной группы и 14,5% - контрольной .
Глюкозамина сульфат обладает хорошим профилем переносимости и высокой безопасностью. Во всех протоколах исследований и мета-анализах не было статистических или клинически значимых различий количества и выраженности нежелательных явлений по сравнению с плацебо. В то же время в сравнительных исследованиях было показано превалирование нежелательных явлений при приеме НПВП, чем глюкозамина . Мета-анализ рандомизированных контролируемых испытаний показал, что наиболее часто встречаются гастроэнтерологические побочные эффекты, которые, как правило, носят слабо выраженный характер. Отмена лечения из-за непереносимости препарата встречалась в единичных случаях. Кардиоваскулярные явления наблюдались у больных пожилого возраста, но они также встречались не чаще, чем у лиц, получающих плацебо. Глюкозамина сульфат не увеличивал резистентность к инсулину.
Другой структурный аналог хряща - хондроитина сульфат также относится к симптоматическим препаратам замедленного действия. Он является сульфатированным мукополисахаридом и входит в состав протеогликановых комплексов, которые синтезируются хондроцитами. Для полноценной функции хрящевой ткани необходимо иметь 2 условия: 1) достаточное количество хондроцитов и 2) они должны быть активны в метаболическом плане и синтезировать достаточное количество внеклеточного матрикса. В состав матрикса и входит хондроитин сульфат. Благодаря наличию карбоксильной и сульфатной групп гликозамингликаны и, в частности, хондроитин сульфат, обладают выраженной гидрофобностью, а это, в свою очередь, способствует нормальному функционированию хряща и сохранению им эластических свойств. При приеме внутрь он в высоких концентрациях определяется в синовиальной жидкости. Его биологическая активность во многом близка гликозамину.
Уровень доказательности хондроитина сульфата в отношении модификации симптомов ОА столь же высок, как и у глюкозамина сульфата (IA), что было отражено в рекомендациях EULAR 2003 г. . Leed B.F. и соавт. провели мета-анализ 7 контролированных клинических исследований, в которых приняли участие 703 больных с поражением крупных суставов (коленных и тазобедренных), при этом 372 больных лечились хондроитин сульфатом и 331- принимали плацебо . Длительность терапии колебалась от 3 до 12 мес., а доза препарата - от 800 до 2000 мг/сут. Эффек-тивность хондроитина сульфата оказалась достоверно более высокой по сравнению с плацебо по таким показателям, как боль по ВАШ, индекс Лекена и глобальной оценке результатов лечения больным. В этом обзоре анализировалась и переносимость препарата, которая оказалась хорошей и была сравнима с плацебо. Нежела-тель-ные явления включали боли в животе (у 18 из 349 больных), диарею (у 7), запоры (у 2), кожные симптомы (у 4), отеки век (у 1), отеки нижних конечностей (у 1), алопецию (у 1) и экстрасистолию (у 1).
Uebelhart D. и соавт. оценивали эффективность и переносимость двух курсов терапии оральным хондроитин сульфатом продолжительностью по 3 мес на протяжении 1 года в рандомизированном двойном слепом, мультицентровом, плацебо-контролированном исследовании у 120 больных с симптоматическим ОА коленного сустава . Первичную эффективность рассматривали по оценке альго-функционального индекса Лекена, а вторичную - по динамике ВАШ, скорости прохождения определенного расстояния, глобальной оценке эффективности терапии, потребности в парацетамоле. Ширину суставной щели оценивали в медиальном отделе тибио-феморального сустава. В анализ intent-to-treat было включено 110 из 120 больных. К концу наблюдения альго-функциональный индекс уменьшился в основной группе на 36% и в контрольной - на 23%. Дальнейший анализ показал, что хондроитина сульфат обладал не только достоверным симптом-модифицирующим, но и структурно-модифицирующим действием. К концу года отмечалось дальнейшее уменьшение суставной щели у больных, которые принимали плацебо, чего не было зафиксировано на фоне терапии хондроитином.
Хондропротективное действие хондроитина сульфата находит свое выражение и в так называемом последействии препарата, т.е. продолжающемся снижении симптоматики ОА после прекращения лечения этим препаратом . Автор подчеркивает, что структур-но-мо-дифици-рую-щий эффект этого препарата доказан как в экспериментальных, так и в клинических исследованиях, причем положительным свойством хондроитина является его низкая токсичность даже при длительном применении.
К комбинированным препаратам с хондропротективной активностью относятся артра, кондронова и Терафлекс. Терафлекс (Bayer, Германия) включает в себя 500 мг глюкозамина гидрохлорида и 400 мг натрия хондроитина сульфата. Он назначается по 2 капсулы 2 раза в сутки на протяжении первых 3- 4 нед, а затем по 2 капсулы в сутки. Длительность приема, как правило, составляет 6 мес.
Терапевтическая активность Терафлекса доказана в нескольких клинических исследованиях . В открытом исследовании, проведенном в Институте ревматологии РАМН Л.И. Беневоленской и соавт., изучалась эффективность, переносимость и безопасность Терафлекса у 50 больных с гон- и коксартрозом . Все больные имели клинически выраженный остеоартроз с болевым синдромом, утренней ригидностью и функциональной недостаточностью опорно-двигательного аппарата, а также потребностью в приеме НПВП. Длительность наблюдения составила 6 мес, причем в первые 4 мес больные принимали по 2 капсулы Тера-флекса вместе с 1200 мг ибупрофена. При получении положительного эффекта можно было снижать суточную потребность в ибупрофене вплоть до полной его отмены. К концу 4 мес непрерывной терапии Терафлекс привел к достоверному снижению суммарного индекса WOMAC, при этом наблюдалось существенная положительная динамика интенсивности боли в суставах, утренней скованности и функциональной недостаточности пораженных суставов. У 26 из 50 больных удалось снизить суточную потребность в ибупрофене. По оценке больных, улучшение к концу второго мес. терапии наблюдалось в 77,8% случаев и к концу четвертого - в 74,4%, а по оценке врача - в 88,6 и 83,7% соответственно. Интересно, что в последующие 2 мес после прекращения лечения продолжала сохраняться терапевтическая эффективность Терафлекса. В этом исследовании была продемонстрирована хорошая переносимость препарата. Нежелательные явления наблюдались лишь у 6 больных и были связаны в основном с приемом ибупрофена. Терафлекс в единичных случаях вызывал появление болей в верхней половине живота и задержку стула.
В другом 6-месячном открытом рандомизированном многоцентровом испытании также проводилась оценка эффективности Терафлекса у больных клинически выраженным остеоартрозом коленного сустава и деформирующим спондилезом . У всех больных боль при ходьбе по шкале ВАШ была выше 40 мм, а рентгенологическая стадия соответствовала I-III стадии по Kellgren и Lawrence. Больные первой (основной) группы принимали Терафлекс с диклофенаком и второй (контрольной) - только диклофенак. К концу 3 мес. в основной группе достоверно уменьшилась интенсивность боли в суставе и оставалась на этом уровне до конца 6 мес. лечения. Во второй группе также наблюдалась положительная динамика этого показателя, хотя и в меньшей степени по сравнению с основной группой. Аналогичная направленность отмечена и функционального индекса WOMAC. К концу 6 мес. лечения в первой группе по оценке врача зарегистрировано значительное улучшение у 23,3% больных и улучшение - у 60%, а в контрольной - у 16,7 и 40% соответственно. В то же время неэффективность проводимой терапии зарегистрирована у 23% больных, принимающих диклофенак, и только у 3,3% - в группе больных, которые наряду с диклофенаком принимали Терафлекс. Как и в предудущем исследовании, наблюдалась хорошая переносимость Терафлекса. Всего в основной группе выявлено 5 нежелательных явлений и в контрольной - 8. На фоне приема Терафлекса наблюдались изжога, боли в верхней половине живота, метеоризм, которые были слабо выраженными и не требовали отмены лечения этим препаратом. В одном случае наблюдалась аллергическая реакция, сопровождающаяся кожной сыпью.
Большой интерес представляет мультицентровое двойное слепое исследование Glucosamin/|chondroitin Arthritis Intervention Trial (GAIT), проведенное в США под эгидой Национального института здоровья . В этом исследовании приняли участие 1583 больных с симптоматическим ОА коленного сустава. Все больные были распределены на 5 групп. В отдельных группах больные принимали или 1500 мг глюкозамина гидрохлорида, или 1200 мг хондроитина сульфата, или комбинацию глюкозамина и хондроитина, или 200 мг целекоксиба или плацебо. Длительность терапии составила 24 нед. Первич-ной точкой являлось снижение интенсивности боли по шкале WOMAC в коленных суставах на 20% и более к 24 неделе. При всей неоднозначности дизайна этого исследования и большого процента больных, у которых отмечалось существенное снижение интенсивности боли на плацебо, были получены интересные данные. Больных с изначально выраженными или тяжелыми болями в коленных суставах оказалось больше всего в группе на комбинированной терапии глюкозамином и хондроитином и статистически значимо выше по сравнению с группой плацебо (79 и 54,3% соответственно, р=0,002). Неблагоприятные явления отмечались редко, были умеренно выраженными и встречались примерно одинаково часто в отдельных группах.
Целесообразность проведения комбинированной терапии и ее структурно-модифицирующее действие подтверждают экспериментальные данные по исследованию эффективности одновременного применения хондроитина сульфата и глюкозамина гидрохлорида. Комбиниро-ван-ная терапия на модели ОА у кроликов способствовала нарастанию продукции глюкозаминогликанов хондроцитами на 96,6%, а на фоне монотерапии структурными аналогами хряща - только на 32% . При комбинированной терапии поражение хряща было также менее тяжелым по сравнению с применением гликозамина или хондроитина. Следует иметь в виду, что структурные аналоги хряща имеют не только общие, но и отличительные механизмы своего влияния на боль и воспаление. В то же время они являются синергистами и при совместном применении дополняют и усиливают действие друг друга.
Таким образом, Терафлекс обладает отчетливым симптом-модифицирующим действием у больных ОА, которое проявляется снижением интенсивности боли и улучшением функции пораженных суставов. Он также позволяет снизить суточную потребность в НПВП. Что же касается доказательства его структурно-модифицирующих свойств, то для этого необходимо проведение длительного лечения этим препаратом (на протяжении ряда мес или даже лет) с тщательным анализом ширины суставной щели по данным рентгенологического и МРТ исследований, а также определения объема суставного хряща до и после проведения такой терапии.
В настоящее время вопрос о непосредственно хондропротективном действии структурных аналогов хряща решается неоднозначно. Все больше исследователей придерживаются точки зрения, что так называемые хондропротективные препараты не столько стимулируют синтез матрикса хряща, т.е. протеогликаны, гликозаминогликаны и гиалуроновую кислоту хондроцитами, сколько обладают антивоспалительным действием, которое реализуется при длительном их назначении. Позитивное решение данной проблемы во многом связано с отсутствием высоко информативных методов, которые позволяют адекватно судить о сохранности хрящевой ткани и удовлетворяют требованиям, предъявляемым к критериям прогрессирования ОА. В этом плане представляется актуальным разграничить клинические критерии ОА и факторы, не связанные с этим заболеванием, выявить особенности прогрессирования ОА тазобедренного сустава, отличные от ОА коленного сустава. Не менее актуальным представляется проведение при этом заболевании дальнейших углубленных исследований по уточнению взаимоотношений между клиническими, рентгенологическими, артросонографическими и МРТ данными.

Литература
1. Volpi N. Chondroitin sulphate for the treatment of osteoarthritis. Curr Med Chem - Anti-Inflammatory and Anti-Allergy Agents, 2005; 4: 221-234.
2. Jordan KM, Arden NK, Doherty M et al. EULAR Recommendations 2003: an evidence based approach to the management of knee osteoarthritis: Report of a Task Force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT). Ann Rheum Dis 2003; 62: 1145-1155.
3. Brandt KD. Diagnosis and nonsurgical management of osteoarthritis. Proffessional communications, 2000.
4. Бадокин В.В. Значение воспаления в развитии и течении остеоартроза. Consilium medicus 2009; 11(9): 91-95.
5. Wesseling J, Dekker J, van den Berg WB, et al. CHECK (Cohort Hip and Cohort Knee): similarities and differences with the Osteoarthritis Inivaties. Ann Rheum Dis 2009; 68: 1413-19.
6. Кригштейн О.С., Голубев Г.Ш. Оценка доказательств эффективности средств, претендующих называться «структурно-модифицируюими препаратами», 20040-2007 гг. Клинич. фармакология и фармакоэкономика 2008; 1: 55-88.
7. Алексеева Л.И. Симптоматические препараты замедленного действия при лечении ОА. Consilium medicus 2009; 11 (9): 100-104.
8. Herrero-Beaumont G, Rovati LC. Use of crystalline glucosamine sulphate in osteoarthritis. Future Rheumatol 2006; 1 (4): 397-414.
9. Towheed TE, Maxwell L, Anastassiades TP et al. Glucosamine therapy for treating osteoarthritis. Cochrane Database Syst. Rev. 2005; CD002946.
10. Reginster JY, Deroisy R, Rovati LC et al. Long-term effects of glucosamine sulphate on osteoarthritis progression: a randomised, placebo-controlled clinical trial. Lancet 2001; 357: 251-256.
11. Pavelka K, Gatterova J, Olejarova M et al. Glucosamine sulphatе use and delay of progression of knee osteoarthritis: a 3-year, randomized, placebo-controlled, double-blind study. Arch Intern Med 2002; 162 (18): 2113-2123.
12. Bruyere O, Pavelka K, Rovati LC et al. Total joint replacement after glucosamine sulphatе treatment in rnee ostheoarthritis: results of a mean 8-year observation of patients from two previous 3-year, randomized, placebo-controlled trials. Osteoarthritis Cartilage 2008; 16 (2): 254-260
13. Leeb BF, Schweitzer H, Montag K, Smolen JS. A Metaanalysis of Chondroitin Sulphate in the Treatment of Osteoarthritis. J Rheumatol 2000; 27: 205-211.
14. Uebelhart D, Malaise V, Marcolongo R et al. Intermittent treatment of knee osteoarthritis with oral chondriitin sulfate: a one-year, randomized, double-blind, multicenter study versus placebo. Osteoarthritis Cartilage 2004; 12: 269-276.
15. Беневоленская Л.И., Алексеева Л.И., Зайцева Е.М. Эффективность препарата Терафлекс у больных остеоартрозом коленных и тазобедренных суставов. РМЖ 2005; 8: 525-527.
16. Поворознюк В.В. Глюкозамин и хондроитин в лечении остеоартроза: данные литературы и результаты собственных исследований. РМЖ 2006; 14 (4): 290-294.
17. Лила А.М., Мазуров В.И., Шидловская О.В., Шостак М.С. Терафлекс в комплексной терапии остеоартроза коленных суставов и остеохондроза позвоночника (результаты клинического исследования). РМЖ 2007; 13 (24): 1618-1622.
18. Сlegg DO, Reda DJ, Harris CL et al. Glucosamine, chondroitin sulphate, and the two in combination for painful knee osteoarthritis. N Engl J Med 2006; 354 (8): 795-808.
19. Lippielo L., Woodword J., Karpman D. et al. Beneficial effect of cartilage structure modyifing agents tested in chondrocyte and rabbit instability model osteoartrosis. Arthr. Rheum., 1999, suppl. 42, 256.
20. Mastbergen SC, Jansen NWD, Bijlsma JWJ, et al. Differential direct effects of cyclo-oxygenase-1/2 inhibition on proteoglycan turnover of human osteoarthritic cartilage: an in vitro study. Arthritis Research & Therapy 2006, 8:R2doi:10.1186/ar1846.
Это системное заболевание соединительной ткани с поражением главным образом периферических суставов, а также внутренних органов. Согласно статистическим данным ревматоидным артритом страдает приблизительно 1% людей всего земного шара. Средний возраст начала болезни - сорок-пятьдесят лет. Чаще болеют женщины, нежели мужчины.
Оглавление:Причины возникновения
Природа ревматоидного артрита очень сложна. Основной причиной возникновения патологии считают аутоиммунный процесс, когда иммунная система воспринимает собственные клетки чужеродными и атакует их. Предполагается, что подобная аномальная активность обусловлена генетической предрасположенностью.
К факторам, запускающим болезнь, относят:
- Инфекционные агенты (вирусы , вирус );
- Переохлаждение;
- Эндокринные нарушения;
- Травмы и операции;

Симптомы ревматоидного артрита
Ревматоидный артрит протекает с поражением суставов, а также внутренних органов. Выраженность клинической картины болезни зависит от степени активности патологического процесса:
- I - Низкая степень активности;
- I I - Умеренная;
- III - Высокая;
- 0 - Ремиссия.
Болезнь впервые проявляет себя в виде общих, неспецифических симптомов. Человек отмечает, что он стал быстро уставать, чувствует себя слабым. Периодически незначительно повышается температура, казалось бы, без видимых на то причин, появляется потливость. Отмечаются мышечные боли, ломота в теле. Зачастую болезнь развивается медленно, клиническая симптоматика разворачивается в течение нескольких месяцев, а иногда и лет. В это время начинают проявляться признаки поражения суставов. Гораздо реже болезнь развивается остро или подостро.

Суставные симптомы
Ревматоидный артрит имеет несколько особенностей, которые позволяют безошибочно дифференцировать его от прочих заболеваний. В большинстве случаев болезнь проявляется полиартритом (поражением более трех суставов), реже олигоартритом (поражением двух суставов) или моноартритом (поражением лишь одного сустава).
При ревматоидном артрите суставы поражаются симметрично, то есть если поражается сустав пальца на левой руке, то на правой руке также наблюдается воспаление аналогичного сустава. Чаще всего поражаются следующие суставы:
- Пястно-фаланговые (за исключением сустава большого пальца);
- Проксимальные межфаланговые;
- Плюснефаланговые;
- Коленные;
- Лучезапястные;
- Локтевые;
- Голеностопные.

Характерный признак ревматоидного артрита - возникновение утренней скованности . Этот симптом характеризуется тем, что после пробуждения человек отмечает затруднение подвижности и усиление болезненности в суставах. Данный симптом развивается из-за того, что ночью в полости пораженного сустава скапливается воспалительный экссудат, который ограничивает функцию сустава. Подобное состояние длится более получаса. Постепенно скованность исчезает и человек начинает чувствовать себя комфортнее, подвижность в суставе восстанавливается. В целом для ревматоидного артрита характерны постоянные ноющие суставные боли.

Ревматоидный артрит прогрессирует в три стадии. На первой стадии развиваются отек синовиальной сумки сустава и продуцирование воспалительного экссудата, что проявляется внешне припухлостью сустава, локальным повышением температуры кожи, болью. На второй стадии клетки соединительной ткани активно делятся, из-за чего уплотняется синовиальная оболочка. На третьей стадии воспаленными клетками продуцируется особый фермент, который приводит к деформации суставов, усилению болей и утрате двигательной функции. В зависимости от места локализации патологического процесса могут наблюдаться такие виды деформаций кисти, как веретенообразные пальцы, шея лебедя, по типу бутоньерки.

Внесуставные симптомы
Поскольку ревматоидный артрит заболевание системное, у многих пациентов развивается поражение многих внутренних органов. Зачастую поражаются такие органы, как:
- Кожа;
- Сердце;
- Легкие;
- Почки;
- Орган зрения;
- Нервная система.
 У 20-50% больных возникают ревматоидные подкожные узелки
. Они представляют собой плотные подкожные безболезненные образования диаметром до двух сантиметров. Зачастую узелки возникают в области локтя, ахиллова сухожилия, над мелкими суставами кисти.
У 20-50% больных возникают ревматоидные подкожные узелки
. Они представляют собой плотные подкожные безболезненные образования диаметром до двух сантиметров. Зачастую узелки возникают в области локтя, ахиллова сухожилия, над мелкими суставами кисти.
Ревматоидные узелки могут возникать и во внутренних органах, например, в легких. Нередко у больных ревматоидным артритом поражается плевра легких с развитием плеврита и интерстициальная ткань с развитием интерстициальной . Считается, что смертность от легочной патологии среди больных ревматоидным артритом выше в два раза, чем в общей популяции.
Поражение сосудов проявляется в виде васкулита, который лежит в основе заболеваний многих органов. На коже васкулит проявляется геморрагической сыпью.
При ревматоидном артрите может наблюдаться поражение любого слоя сердца: эндокарда, перикарда, миокарда. Чаще всего отмечается перикардит - воспаление околосердечной сумки, иногда сопровождающееся выпотом. Стоит отметить, что у больных ревматоидным артритом уже в молодые годы наблюдается .

Серьезную угрозу для жизни представляет поражение почек. При воспалении почечных клубочков развивается , который в дальнейшем может стать причиной . У больных с длительно текущей формой ревматоидного артрита может возникнуть амилоидоз почек - отложение в них патологического белка амилоида.
Кроме того, при этой болезни может поражаться орган зрения в виде сухого кератоконъюнктивита, нервной системы в виде невропатии, поражение мышц - в виде мышечной слабости и боли.

Диагностика ревматоидного артрита
Диагностика ревматоидного артрита очень обширная. Для выявления заболевания могут использоваться неспецифические, специфические и вспомогательные методы исследования.
Неспецифические методы диагностики
 Прежде всего, проводятся традиционные общеклинические исследования. В определяются увеличение количества лейкоцитов, ускорение СОЭ, .
Прежде всего, проводятся традиционные общеклинические исследования. В определяются увеличение количества лейкоцитов, ускорение СОЭ, .
При удается обнаружить повышение уровня фибриногена, сиаловых кислот, а также С-реактивного белка, гаптоглобина. Однако подобные изменения неспецифичны и могут наблюдаться при различных заболеваниях.
Специфические методы диагностики
Подтвердить диагноз ревматоидного артрита позволяет определение специфических маркеров ревматоидного процесса . В частности, приблизительно у 60% больных в крови обнаруживается ревматоидный фактор . Это аутоантитела к собственным иммуноглобулинам G. Высокие титры фактора коррелируют с тяжестью, быстрым прогрессированием патологического процесса. Если у больного удалось обнаружить ревматоидный фактор - медики говорят о серопозитивном ревматоидном артрите, если фактор не обнаруживается - о серонегативном.
Одним из наиболее чувствительных методов, что позволяет использовать его в диагностике заболевания на раннем этапе заболевания, является определение антицитруллиновых антител (АЦЦП) . Цитруллин - это аминокислота, которая образуется при воспалении. Клетки, содержащие цитруллин, распознаются иммунной системой чужеродными, из-за чего продуцируются антитела к ним. При ревматоидном артрите тест на АЦЦП положителен приблизительно в 80% случаев.

Вспомогательные методы диагностики
 Вспомогательным методом диагностики является исследование синовиальной жидкости
. В жидкости удается обнаружить такие изменения как снижение ее вязкости, увеличение лейкоцитов и нейтрофилов, изменение цвета, прозрачности. По большому счету подобные изменения наблюдаются и при других воспалительных заболеваниях суставов. Достоверно подтверждает наличие ревматоидного артрита обнаружение в синовиальной жидкости ревматоидного фактора.
Вспомогательным методом диагностики является исследование синовиальной жидкости
. В жидкости удается обнаружить такие изменения как снижение ее вязкости, увеличение лейкоцитов и нейтрофилов, изменение цвета, прозрачности. По большому счету подобные изменения наблюдаются и при других воспалительных заболеваниях суставов. Достоверно подтверждает наличие ревматоидного артрита обнаружение в синовиальной жидкости ревматоидного фактора.
Для исследования пораженных суставов применяют рентгенологическое исследование и артроскопию. Ранние рентген-признаки это околосуставной , нечеткость контуров сустава, эрозии на суставных поверхностях.
Лечение ревматоидного артрита
Рекомендуем прочитать:Больным ревматоидным артритом необходимо проходить лечение в ревматологическом стационаре. В терапии используют следующие группы лекарственных средств:
- Симптом-модифицирующие препараты;
- Болезнь-модифицирующие (они же базисные) противоревматические препараты;
- Болезнь-контролирующие препараты.

Симптом-модифицирующие препараты
Предназначение этой группы препаратов - быстрое уменьшение местных воспалительных явлений, боли, пока не подействуют базисные средства. К этой группе препаратов относят НПВС и глюкокортикоиды.
НПВС оказывают противовоспалительный, жаропонижающий и болеутоляющий эффекты. Противовоспалительный эффект реализуется за счет угнетения фермента циклооксигеназы, принимающей участие в синтезе медиаторов воспаления. Различают две ее изоформы: ЦОГ1 и ЦОГ2. Соответственно различают НПВС воздействующие преимущественно на ЦОГ1 или ЦОГ2. К первым относят Ибупрофен, Диклофенак, Индометацин, ко вторым - Мелоксикам, Целекоксиб. И те, и другие оказывают противовоспалительный эффект. Однако блокаторы ЦОГ2 не оказывают агрессивного воздействия на слизистую желудочно-кишечного тракта, в отличие от блокаторов ЦОГ1.

Выраженным противовоспалительным эффектом обладают глюкокортикостероиды. Низкие дозы глюкокортикоидов используют в качестве «бридж-терапии» до того момента, пока не начнут оказывать действие базисные противоревматические средства. В некоторых случаях вводят большие дозы глюкокортикоидов за несколько дней, что называется «пульстерапия». Глюкокортикоиды также применяют местно - путем введения в пораженный сустав. Однако в таком случае удается подавить лишь местное воспаление.
Базисные противоревматические препараты
Это препараты, которые оказывают эффект не сразу, но за счет их способности вмешиваться в иммунные механизмы болезни они способны привести к длительной ремиссии.
К базисным препаратам относят:
- Д-пеницилламин;
- Препараты золота;
- Салазосоединения;
- Цитостатики;
- Хинолиновые производные.
Принцип терапии базисными препаратами: вначале назначают высокие дозы препарата для подавления воспалительного процесса. В дальнейшем дозу лекарства понемногу снижают и достигают терапевтической дозы, которую необходимо употреблять длительно. Если спустя четыре-шесть месяцев лечения тем или иным базисным препаратом положительного результата добиться не удается - значит, необходимо поменять медикамент.

Болезнь-контролирующие препараты
Действие этих медикаментов (их еще называют биологическими агентами) направлено на угнетение синтезирования «противовоспалительных» цитокинов - ФНО-а и ИЛ-1. Это современные препараты генной инженерии, которые позволяют вылечиться больным с устойчивостью к действию других препаратов.
К этой группе относят следующие препараты:

Несмотря на свою неоспоримую эффективность болезнь-контролирующие препараты имеют и недостатки. Самым главным недостатком является дороговизна препаратов. Поскольку лечиться этими медикаментами нужно длительно, выходит, что подобное лечение может позволить себе далеко не каждый.
Немедикаментозная терапия
Немедикаментозная терапия играет не меньшую роль, чем лечение медикаментами. Так, больным ревматоидным артритом нужно придерживаться диеты, которая подробно описана в статье « ». Желающим выздороветь нужно отказаться от курения, ведь оно ухудшает течение заболевания.
Больным показаны умеренные (не чрезмерные!) гимнастические упражнения, массаж. Благоприятно влияет на протекание болезни санаторное лечение и физиопроцедуры (бальнеотерапия, грязелечение, лазеротерапия, магнитотерапия, УВЧ, электрофорез). Физиопроцедуры проводят после затихания острого воспалительного процесса. При их правильном применении удается улучшить подвижность суставов и уменьшить боль.
Григорова Валерия, медицинский обозреватель
Дата публикации статьи: 08.08.2016
Дата обновления статьи: 28.01.2020
Артрит – общее название группы болезней суставов воспалительного характера различной природы происхождения. Воспаление одного или одновременно нескольких суставов может быть как самостоятельным заболеванием, так и проявлением системной патологии организма.
Что такое артрит в доступном понимании? Если говорить простым языком, то это воспаление хряща, синовиальной оболочки, капсулы, суставной жидкости и остальных элементов сустава.
Существует более 10 видов артрита (подробнее про них – далее в статье). Механизм развития разных видов болезни практически одинаков за исключением некоторых нюансов.
Патология негативно влияет на качество жизни пациента, ее основные симптомы: болевой синдром, опухание и покраснение пораженной области, местное повышение температуры, ограничение движений, деформация сустава. Человеку становится трудно выполнять повседневные дела, а при тяжелом течении болезни – даже элементарные движения. Хронические длительно протекающие артриты нередко приводят к частичному или полному обездвиживанию с оформлением группы инвалидности.
Любой вид артрита поддается лечению (какие-то виды лечатся лучше и легче, какие-то – хуже), особенно в настоящее время (статья написана в 2016 году), когда разработаны и успешно применяются множество лечебных методик, позволяющих эффективно бороться не только с симптомами болезни, но и с ее причиной и следствиями.
Лечить артрит могут врачи следующих трех специальностей: врач-ревматолог, артролог, ортопед-травматолог. Если воспаление суставов развилось на фоне туберкулеза, сифилиса, бруцеллеза или другой инфекции, то упор делают на лечение основного заболевания, которым занимается, соответственно, фтизиатр, инфекционист или дерматолог-венеролог.
Ниже я детально опишу виды, причины и симптомы артрита, расскажу о современных методах диагностики и способах лечения болезни.
Виды артритов
| Градация артритов по категориям | Виды |
|---|---|
|
Воспалительные артриты |
Псориатический |
|
Ревматический |
|
|
Ревматоидный |
|
|
Реактивный |
|
|
Инфекционный |
|
|
Туберкулезный |
|
|
Дегенеративные артриты |
Травматический |
|
Остеоартрит |
|
|
С учетом причины и механизма развития |
Первичные – анкилозирующий спондилоартрит, болезнь Стилла, псевдоподагра, ревматический, псориатический, септический, ювенильный артрит, различные виды специфических инфекционных артритов (вирусный, дизентерийный либо гонорейный). |
|
Вторичные – возникают на фоне основной патологии, например, злокачественной опухоли, остеомиелита, аутоиммунных заболеваний, саркоидоза, гепатита, боррелиоза, некоторых болезней крови, легких или ЖКТ. |
|
|
По числу пораженных суставов |
Моноартрит – изолированное воспаление только одного сочленения, обычно крупного |
|
Олигоартрит – поражение не больше 3 суставов |
|
|
Полиартрит – воспаление одновременно 3–6 как крупных, так и мелких суставов |

По характеру происходящих изменений артриты делят на:
- воспалительные, для которых характерно наличие воспаления,
- дегенеративные, когда происходит сначала нарушение питания хряща, дистрофия, изменение внешнего вида пораженного сустава с последующей его деформацией.
Артрит протекает в острой, подострой и хронической форме. Для воспалительного поражения наиболее характерно острое или подострое течение, для дегенеративно-дистрофического – хроническое.
Острый воспалительный процесс бывает: серозного, серозно-фиброзного, гнойного характера.
Самое «безобидное» воспаление с образованием и накоплением серозной (прозрачной) жидкости в синовиальной сумке бывает при синовите – воспалении оболочки сустава.
Особо тяжелый артрит – гнойный. При нем воспаление затрагивает, кроме суставной сумки, еще и прилегающие к ней ткани, а в суставной жидкости появляется гной из-за активного размножения патогенных микроорганизмов. Развитие гнойного процесса чревато формированием капсульной флегмоны (когда гнойный процесс захватывает весь сустав).
Причины заболевания
Общие (основные) причины
- Наследственность;
- травмы;
- ожирение;
- нарушение обмена веществ в организме;
- частые переохлаждения;
- инфекции;
- нерациональные распределение физической активности: то долгое нахождение в сидячем положении, то чрезмерные физические нагрузки;
- острые бактериальные, вирусные либо грибковые инфекции;
- болезни нервной системы;
- аутоиммунные заболевания.
Дополнительные причины
- Операция на суставе,
- преклонный возраст,
- роды,
- ослабленный иммунитет,
- вакцинация,
- аллергия,
- неоднократные аборты,
- неправильное питание,
- неблагоприятная экологическая обстановка,
- недостаток минералов и витаминов.

Неправильное питание – основная причина подагрического артрита
Причины конкретных видов артрита
(если таблица видна не полностью – листайте ее вправо)
| Виды артритов | Причины |
|---|---|
|
Травматический |
Травмы элементов сустава: ушибы, переломы подлежащих к сочленению костей, рваные раны в области сустава и т.п. |
|
Вибрационный |
Регулярные чрезмерные нагрузки на суставы, вынуждающие производить движения при большой нагрузке |
|
Реактивный |
Разные инфекции, возбудителями которых являются уреаплазмы, хламидии, микоплазмы, дизентерийная палочка, клостридии, сальмонелла, вирусы гриппа и др. |
|
Ревматоидный |
Точно не установлены, но высока вероятность влияния наследственности; аутоиммунных заболеваний; герпесвирусов (вируса Эпштейна-Барра, простого герпеса, цитомегаловируса); гепатовирусов, ретровирусов |
|
Псориатический |
Инфекции |
|
Генетические и аутоиммунные механизмы |
|
|
Остеоартрит |
Недостаточное питание хрящей в результате нарушения обменных процессов в организме |
|
Дисплазии – врожденные аномалии развития элементов сустава |
|
|
Системные болезни – склеродермия, волчанка и др. |
|
|
Гормональные нарушения |
|
|
Специфическое и неспецифическое воспаление суставных структур. Первое – на фоне туберкулеза, гонореи, дизентерии. Второе – как самостоятельное поражение без участия болезнетворных возбудителей |
|
|
Поражение, разрушение суставов при болезни Пертеса, остеохондрите |
|
|
Гемофилия – наследственное нарушение свертываемости крови |
|
|
Подагрический |
Наследственность |
|
Нарушение белкового обмена на фоне неправильного питания с чрезмерным употреблением пищи, богатой особыми веществами – пуринами(скумбрия, сельдь, сардины, мясо) |
|
|
Избыток массы тела |
На развитие ревматоидного артрита влияет сбой работы иммунитета. По непонятным причинам особые клетки иммунной системы начинают «атаковать» собственные ткани суставов. В результате начинается аутоиммунное воспаление, протекающее с разрастанием агрессивной ткани с опухолеподобным развитием, из-за которой повреждаются связки, суставные поверхности, разрушаются хрящи и подлежащие к ним кости. Это приводит к развитию фиброза, склероза, эрозий, в итоге – к контрактурам, подвывихам, стойкой неподвижности сустава – анкилозу.

Характерные симптомы
Ведущий симптом болезни артрит – это боли в одном или нескольких суставах. Сначала они слабые и практически никак не сказываются на обычной жизни человека. Со временем болевой синдром нарастает: боли приобретают волнообразный характер, усиливаясь при движении, в ночное время и ближе к утру. Интенсивность болей варьирует от слабой до очень сильной, резко затрудняющей любое движение.
Вторичные симптомы:
- утренняя скованность,
- опухание,
- покраснение кожи,
- повышение местной температуры в зоне воспаления,
- ухудшение двигательной активности больного,
- ограничение его подвижности,
- формирование стойких деформаций суставов.
В зависимости от течения процесса ограничение функциональности пораженных суставов бывает как легкой, так и тяжелой степени с возможным полным обездвиживанием конечности.
Рассмотрим симптомы некоторых видов артрита детальнее.
Травматический артрит
Травматическое повреждение суставных элементов сопровождается воспалительной реакцией, а если в полость проникли болезнетворные микробы – то гнойным воспалением суставной жидкости и сумки, постепенно переходящим на близлежащие ткани сустава.
Симптомы ревматоидного артрита
Такой вид артрита характеризуется симметричных поражением коленных, лучезапястных, локтевых, голеностопных суставов, а также мелких сочленений пальцев рук и стоп. Воспаление тазобедренных, плечевых и суставов позвоночника менее характерно, но тоже возможно.
При остром или подостром течении недуга человека беспокоят резкие боли в мышцах и суставах, сильная слабость, лихорадка, скованность в мелких суставах по утрам.
Хронический вялотекущий процесс протекает с болями слабой степени выраженности, постепенным нарастанием суставных изменений, которые обычно не сопровождаются существенным ограничений функций конечностей.
Постепенно воспаление переходит на близлежащие к суставу мышцы. В результате развивается их очаговое воспаление, сила мышц и их тонус снижаются, больной ощущает мышечную слабость, сильную усталость после обычной физической нагрузки.
Типичный симптом – появление подкожных узелков округлой формы с диаметром не больше 2 см. Они же могут сформироваться на клапанах сердца и в легких.

Для этого вида болезни характерна асимметричность поражения одновременно 2 либо 3 суставов. Причем сначала воспаляются мелкие сочленения пальцев стоп и кистей, затем крупные – колени, локти, плечи и др.

Развитие олигоартрита (воспаления не более 3 суставов) сопровождается воспалением оболочек вокруг сухожилий, повышением температуры воспаленного места и покраснения кожи, припухлостью и болезненностью суставов.
Болевой синдром выражен в покое или ночью, утренняя скованность и болезненность проходит в течение дня.
Диагностика
Установка точного диагноза базируется на совокупности клинических проявлений, данных осмотра врача и результатах лабораторной диагностики, подтверждающих наличие артрита (данные диагностики также помогают определить вид, стадию, степень активности процесса).
При обследовании с визуальным осмотром и пальпацией беспокоящих суставов врач отмечает отечность, покраснение кожи, которая горячая на ощупь; при запущенной болезни отмечается видимая деформация сочленения.
В таблице ниже – конкретные виды исследований, которые нужно пройти при подозрении на артрит:
(если таблица видна не полностью – листайте ее вправо)
| Методы лабораторной диагностики | Методы инструментальной диагностики |
|---|---|
|
Клинический анализ крови |
Рентгенография сустава в 2 проекциях |
|
«Биохимия» крови (показатели – мочевая кислота, сиаловые кислоты, белковая фракция, СРБ, фибрин, гаптоглобин и др.) |
Цифровая микрофокусная рентгенография – снятие рентгеновского снимка с прямым увеличением, а цифровая система визуализации обеспечивает высокую четкость изображения. Метод позволяет обнаружить минимальные изменения костных структур |
|
Ревматоидный фактор |
Артрография – снятие рентгеновского снимка после введения в полость сустава контрастного вещества |
|
Антистрептолизин-О |
УЗИ пораженных суставов |
|
Цитологическое и микробиологическое исследование синовиальной жидкости |
Сцинтиграфия – получение двухмерного изображения патологической области после введения в организм радиоактивного изотопа |
|
При необходимости проводят биопсию суставной оболочки и потом изучают ее |
Диагностическая артроскопия – высокоинформативный метод осмотра структур сустава через артроскоп с миниатюрной видеокамерой |
Методы лечения
Любой вид артрита имеет несколько стадий развития. Для каждой подбирают определенные способы лечения: для первой и второй достаточно консервативной терапии, для третьей и при наличии осложнений может потребоваться хирургическое вмешательство.
В таблице представлена общая схема лечения артритов.
(если таблица видна не полностью – листайте ее вправо)
| Методы лечения | Подробности |
|---|---|
|
Медикаментозная терапия |
Нестероидные противовоспалительные препараты внутрь, в/м и (или) внутрисуставно. |
|
Кортикостероиды внутрь и внутрисуставно. |
|
|
Эфферентная терапия |
Криоаферез – лечебная методика, в основе которой лежит обработка холодом или специальными химическими веществами взятой у пациента плазмы. После чего ее вводят обратно пациенту. |
|
Каскадная фильтрация плазмы (плазмаферез) – очищение плазмы от токсинов, антител, гормонов, других веществ, уровень которых в организме резко повышен. |
|
|
Физиолечение и массаж (после стихания острого воспалительного процесса) |
Амплипульстерапия, фонофорез, электрофорез, магнито- и лазеротерапия, аппликации с озокеритом и парафином, УФО, УВЧ. |
|
Лечебная физкультура |
Упражнения ЛФК направлены на предупреждение функциональных нарушений и развития контрактур. |
|
Хирургическое лечение |
Виды: артротомия, иссечение синовиальной оболочки (синовэктомия), артродез, резекция сустава, лечебная артроскопия, хейлэктомия. При разрушении сустава показана реконструктивная артропластика либо эндопротезирование (замена сустава). |

Методы лечения артрита
Методы лечения разных видов артрита очень схожи, различия лишь в некоторых конкретных нюансах, например:
- При специфических артритах лечат основное заболевание (при туберкулезе упор делают на противотуберкулезные средства).
- Для снижения активности псориатического артрита вышеперечисленные способы дополняют ультрафиолетовым или лазерным облучением крови, гемосорбцией. А из физиопроцедур эффективна ПУВА-терапия, сочетающая прием внутрь специального фотосенсибилизирующего препарата с наружным облучением длинноволновыми ультрафиолетовыми лучами.
Резюме
Только скрупулезно соблюдая рекомендации врача можно победить артрит. Прогноз обычно благоприятный, но он полностью зависит от своевременности обращения к специалисту и доведения лечения до конца. Современные методики позволяют поправить даже самую запущенную ситуацию, сделав операцию на суставе.
Владелец и ответственный за сайт и контент: Афиногенов Алексей .
Читайте еще, вам понравится:

Изменяющих течение заболевания, служит их способность замедлять эрозивное поражение сустава, обеспечивая контроль над воспалением синовиальных оболочек. Механизм действия большинства старых противоревматических препаратов остается неизвестным.
1. Противомалярийные препараты. Эти препараты, включая гидроксихлорохин и хло-рохин, представляют менее мощные противоревматические препараты и часто применяются для лечения ранних или легких проявлений РА в комбинации с НПВП.
Гидроксихлорохин хорошо переносится, однако отличается замедленным развитием терапевтического действия, что характерно для большинства старых противоревматических препаратов. Пациенты могут не замечать терапевтический эффект на протяжении 3-6 месяцев терапии. Если общая суточная доза не превышает 5,5 мг/кг/сут и никогда не превышает 400 мг/сут, выраженное токсическое действие на сетчатку глаза встречается редко. Однако всем пациентам рекомендуется проводить ежегодное офтальмологическое обследование для своевременного выявления ретинопатии.
2. Метотрексат. Метотрексат - препарат из группы антагонистов фолиевой кислоты. Нарушает синтез ДНК, однако противоревматический эффект может быть обусловлен и другими противовоспалительными свойствами препарата.
Для большинства пациентов с активным РА метотрексат - препарат первого выбора в связи с его доказанной и стойкой эффективностью и умеренной контролируемой токсичностью, а также более благоприятным соотношением стоимость/эффективность по сравнению с некоторыми новыми противоревматическими препаратами. Примерно у 60% пациентов с РА отмечена достаточно высокая эффективность метотрексата, сравнимая с эффективностью новых препаратов, таких как этанерцепт.
Метотрексат, как правило, назначается 1 раз в неделю перорально в дозе от 7,5 до 15 мг. Доза может повышаться через 4-6 недель на 2,5-5 мг, в зависимости от терапевтического ответа. При отсутствии выраженных признаков токсического действия доза препарата при необходимости может повышаться до 20-25 мг в неделю. Терапевтический ответ на препарат наступает в течение 4-12 недель. Клинические показатели эффективности терапии включают уменьшение утренней скованности и общей утомляемости, а также уменьшение количества отечных и болезненных при пальпации суставов. У многих пациентов, при условии начала лечения на раннем этапе, контроль над симптомами заболевания может быть достигнут, по крайней мере, в течение 1 года на фоне монотерапии метотрексатом.
Метотрексат выделяется почками и противопоказан пациентам с уровнем креатинина, превышающим 2,0-2,5 мг/дл. Метотрексат не додженназначаться пациентам, злоупотребляющим алкоголем, в связи с риском токсического действия на печень. В целом ограничение приема алкоголя до дозы, эквивалентной одному стакану вина 1-2 раза в неделю, - разумное решение для пациентов, принимающих метотрексат. Рекомендуется регулярный контроль функции печени (общий анализ крови, уровень аспартат аминотрансферазы и аланин аминотрансферазы), тем не менее фиброз печени может развиваться и на фоне нормального уровня ферментов печени. Проведение регулярной биопсии печени для контроля признаков фиброза пациентам, получающим метотрексат в терапевтических дозах в качестве противоревматического препарата, в рутинном порядке не рекомендуется.
Если метотрексат противопоказан, альтернативные препараты для первичной терапии включают сульфасалазин, гидроксихлорохин или даже этанерцепт или адалимумаб, в зависимости от тяжести заболевания.
Метотрексат может применяться в комбинации с анти-ФНО терапией (этанерцепт, инфликсимаб или адалимумаб). Результаты современных исследований позволяют предположить, что комбинация метотрексата с анти-ФНО терапией более эффективна, чем монотерапия каждым из препаратов. Однако отдаленное токсическое действие комбинированной терапии в настоящее время неизвестно (т.е. неизвестно, повышается ли риск развития лимфомы). Сравнительный анализ различий по соотношению стоимость/эффективность комбинированной терапии и монотерапии требует дальнейшего изучения. У пациентов с активным ревматоидным артритом, которые не отвечают на монотерапию анти-ФНО препаратами, как в монотерапии, так и в комбинации с метотрексатом, должен рассматриваться вопрос о лечении препаратом анакинра (см. далее).
3. Лефлуномид. Лефлуномид - ингибитор синтеза пиримидина, клинический профиль которого очень близок к метотрексату. Доказано, что терапевтическая эффективность препарата имеет выраженное сходство с действием метотрексата, включая уменьшение выраженности рентгенологических эрозивных изменений. Как и метотрексат, лефлуномид может оказывать токсическое влияние на печень и увеличивать уровень ферментов печени в крови. Диарея - выделение неоформленных (жидких или кашеобразных) испражнений, в большинстве случаев сочетающееся с учащением дефекаций более 2-3 раз в сутки.
" data-tipmaxwidth="500" data-tiptheme="tipthemeflatdarklight" data-tipdelayclose="1000" data-tipeventout="mouseout" data-tipmouseleave="false" class="jqeasytooltip jqeasytooltip3" id="jqeasytooltip3" title="Диарея">Диарея - распространенный побочный эффект лефлуномида, который может потребовать отмены препарата. Терапия лефлуноми-дом начинается с введения нагрузочной дозы (100 мг/сут) в течение трех дней, с последующим переходом на прием препарата в поддерживающей дозе 20 мг 1 раз в сутки. Как и в процессе терапии метотрексатом, субъективное и объективное улучшение состояния больного наблюдается примерно через 6 недель. Нафоне терапии необходим регулярный контроль уровня тромбоцитов (для исключения тромбо-цитопении) и уровня ферментов печени.
4. Сульфасалазин. Хотя первоначально препарат был создан как противовоспалительное противоревматическое Средство, -а; ср. Медицинский препарат или предмет, необходимый при лечении, напр, кровоостанавливающее С. (перекись водорода, жгут).
" data-tipmaxwidth="500" data-tiptheme="tipthemeflatdarklight" data-tipdelayclose="1000" data-tipeventout="mouseout" data-tipmouseleave="false" class="jqeasytooltip jqeasytooltip15" id="jqeasytooltip15" title="Средство">средство еще до эры кортикостероидных гормонов более 60 лет назад, в настоящее время сульфасалазин более широко применяется для лечения воспалительных заболеваний кишечника. Сульфасалазин продемонстрировал умеренную терапевтическую эффективность как противоревматический препарат, способный уменьшать рентгенологические эрозивные изменения и симптомы воспалительного процесса в суставах. Механизм терапевтического действия этого препарата при РА неизвестен, однако Метаболиты, -ое; мн. Промежуточное продукты обмена в-в в клетках человека, многие из к-рых оказывают регулирующее влияние на биохим. и физиол. процессы в организме." data-tipmaxwidth="500" data-tiptheme="tipthemeflatdarklight" data-tipdelayclose="1000" data-tipeventout="mouseout" data-tipmouseleave="false" class="jqeasytooltip jqeasytooltip7" id="jqeasytooltip7" title="Метаболиты">метаболиты препарата - сульфапиридин и 5-ASA - оказывают многочисленные эффекты на свойства иммунных клеток.Предпочтительно назначение сульфасала-зина в таблетках с кишечно-растворимой оболочкой для уменьшения риска токсического действия на желудочно-кишечный тракт. Начальная доза препарата составляет 500 мг/сут и в дальнейшем повышается каждые 1-2 месяца до достижения полной терапевтической дозы 2000 мг/сут. Терапевтическое действие сульфасалазина развивается медленно, и требуется примерно 3 месяца лечения до появления признаков клинического улучшения. Побочные эффекты сульфасалазина включают желудочно-кишечные расстройства (которые могут быть сведены до минимума при применении формы препарата с кишечно-растворимой оболочкой) и, в редких случаях, агранулоци-тоз. Необходимо регулярное проведение общего анализа крови для контроля токсического действия препарата.